In un recente studio pubblicato su Cell, il Dr. Dinshaw Patel e il Dr. Luciano Marraffini, insieme al loro team di ricerca, hanno svelato un nuovo meccanismo attraverso il quale i batteri utilizzano i sistemi CRISPR per proteggersi dai virus invasori. Lo studio, intitolato “The CRISPR-associated adenosine deaminase Cad1 converts ATP to ITP to provide antiviral immunity,” fa luce su una proteina chiamata Cad1 (deaminasi adenosinica associata a CRISPR 1). Patel è titolare della cattedra Abby Rockefeller Mauze in Terapie Sperimentali presso il Memorial Sloan Kettering Cancer Center, mentre Marraffini è a capo del Laboratorio di Batteriologia alla Rockefeller University.
Le scoperte del team offrono una nuova comprensione del funzionamento dei sistemi CRISPR di tipo III, ampliando il ventaglio di strategie immunitarie note nei batteri oltre alla degradazione degli acidi nucleici, tipica di altri meccanismi di difesa CRISPR. In particolare, lo studio si concentra su un dominio proteico all’interno di Cad1 chiamato CARF (Rossman fold associato a CRISPR), che attiva i processi antivirali attraverso una cascata di eventi cellulari innescata dal legame con molecole chiamate oligoadenilati ciclici (cOAs, cyclic oligoadenylates). La proteina Cad1 combina questo dominio CARF con un dominio deaminasi adenosinica, il quale possiede la capacità unica di trasformare l’ATP, la principale molecola energetica della cellula, in inosina trifosfato (ITP).
Quando il sistema CRISPR batterico riconosce una minaccia virale, la proteina Cas10 crea i cOAs. La produzione di cOAs agisce come un segnale di emergenza per il dominio CARF di Cad1, inducendo il legame con queste molecole e l’avvio della deaminazione dell’ATP. Questo processo di deaminazione, in cui Cad1 converte l’ATP in ITP, blocca la crescita cellulare batterica e interrompe il ciclo vitale del virus infettante. La capacità di Cad1 di convertire l’ATP cellulare in ITP rappresenta probabilmente una modalità unica di difesa antivirale utilizzata dai batteri per contrastare efficacemente le infezioni virali.
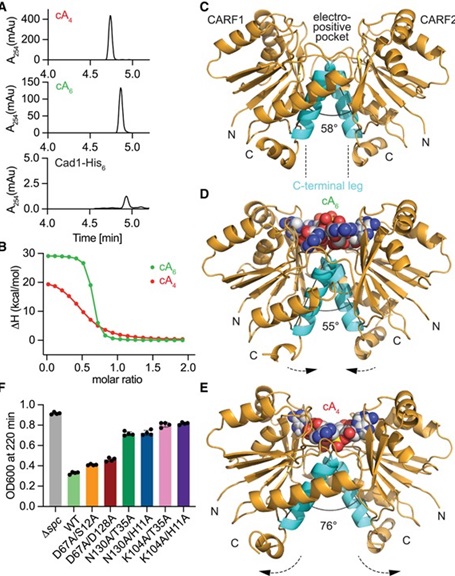
Utilizzando la crio-microscopia elettronica avanzata (cryoelectron microscopy, cryo-EM), i ricercatori hanno svelato l’architettura molecolare di Cad1. Questa proteina si assembla in una struttura a sei unità, o esamero, che posiziona i domini CARF e deaminasi adenosinica in modo da massimizzarne l’attività. Gli studi strutturali del team hanno rivelato che, una volta legati i cOAs, Cad1 si riorganizza in una configurazione che ne potenzia l’efficienza nella conversione di ATP in ITP. Questa struttura non solo supporta la funzione enzimatica di Cad1, ma mostra anche come le molecole di ATP si legano alle tasche interdominio della proteina, un aspetto essenziale per attivare l’azione antivirale di Cad1.
Per studiare il meccanismo d’azione di Cad1, i ricercatori lo hanno introdotto in cellule di Staphylococcus aureus e osservato come rispondeva a cOAs sintetici. Il team ha scoperto che, una volta attivata, Cad1 converte rapidamente l’ATP in ITP, causando un notevole ritardo nella crescita batterica senza uccidere le cellule. Questo blocco della crescita, reversibile e simile a una ‘modalità standby,’ impedisce ai batteri di diventare una fabbrica di replicazione virale, offrendo loro un meccanismo di difesa che arresta la diffusione virale all’interno della popolazione batterica.
Ulteriori analisi hanno dimostrato che la trasformazione dell’ATP in ITP da parte di Cad1 è direttamente collegata a una risposta cellulare specifica all’infezione da fago. Il team ha esplorato l’interazione di Cad1 con diversi tipi di cOAs e ha scoperto che questa viene attivata principalmente da cA4 e cA6, due specifiche molecole cicliche generate dal sistema CRISPR. La capacità di Cad1 di convertire l’ATP in ITP, attivata da queste molecole messaggere, aggiunge un ulteriore livello di specificità al sistema immunitario CRISPR. Questa scoperta suggerisce che i batteri siano dotati di una gamma di strumenti molecolari per attivare una risposta mirata e precisa contro i faghi.
Oltre a fornire un blocco immediato della crescita nelle cellule infette, il metodo unico di deaminazione dell’ATP in ITP da parte di Cad1 può interferire con il macchinario di replicazione virale, che richiede ATP per funzionare. Creando alti livelli di ITP, Cad1 probabilmente interrompe la propagazione virale e limita la diffusione dell’infezione nella popolazione ospite.
Curiosamente, questo studio ha rivelato l’adattabilità di Cad1 a diverse conformazioni strutturali, in particolare la capacità di riconoscere e legare sia i ligandi cA4 che cA6. Questa flessibilità nel legame con i ligandi è significativa, poiché suggerisce un’adattabilità modulare dei sistemi CRISPR nel contrastare diverse strategie di infezione virale. Gli esperimenti del team hanno dimostrato che solo la forma esamerica di Cad1 è attiva nella deaminazione dell’ATP, sottolineando la necessità strutturale di questo assemblaggio per una difesa virale efficace.
Testando l’efficacia di Cad1 contro vari attacchi virali, il team di Patel e Marraffini ha osservato che questa proteina fornisce immunità contro un ampio spettro di faghi che infettano i batteri Staphylococcus. Combinando Cad1 con altri componenti CRISPR, i ricercatori hanno scoperto che questa combinazione offriva il massimo livello di immunità, persino contro attacchi virali che si verificano più tardi nel ciclo di infezione.
Questa scoperta ha importanti implicazioni per la comprensione delle pressioni evolutive che modellano i sistemi immunitari batterici. I risultati rivelano come i sistemi CRISPR continuino a sviluppare nuove strategie, come la deaminazione dell’ATP da parte di Cad1, per rispondere alle diverse minacce poste dai faghi. La ricerca suggerisce che la corsa evolutiva tra batteri e i loro aggressori virali guida lo sviluppo di complesse risposte immunitarie CRISPR, aiutando i batteri a sopravvivere in ambienti sempre più ostili.
Nonostante le scoperte, lo studio presenta alcune limitazioni. Tra queste, il team sottolinea la necessità di cautela nel generalizzare il comportamento esatto di Cad1 in tutti i sistemi batterici, poiché gli esperimenti sono stati condotti utilizzando uno specifico ceppo di Staphylococcus. Studi futuri potrebbero esplorare le sfumature dell’attività di Cad1 in diversi ospiti batterici, così come il preciso percorso molecolare attraverso cui Cad1 diventa cataliticamente attivo in seguito al legame con cOA.

Lascia un commento