Uno studio pioneristico svolto dai ricercatori dell’Università della California – San Francisco (UCSF) ha rivelato un nuovo modo per combattere il cancro, riprogrammando le cellule adipose affinché competano con i tumori per i nutrienti essenziali. I ricercatori hanno sviluppato un metodo chiamato trapianto di manipolazione del tessuto adiposo (adipose manipulation transplantation, AMT), in cui adipociti ingegnerizzati—cellule adipose—vengono impiantati vicino ai tumori per privarli del glucosio e degli acidi grassi necessari per la loro crescita. Modificando questi adipociti affinché consumino energia a un ritmo più elevato, gli scienziati hanno scoperto che i tumori faticavano a sopravvivere e, in molti casi, si riducevano significativamente.
La Scienza Dietro il Metabolismo Tumorale
Le cellule tumorali hanno un insaziabile appetito per i nutrienti, principalmente glucosio e acidi grassi. Nei tumori, l’assorbimento di glucosio avviene a un ritmo significativamente più elevato, portando alla produzione di lattato anche in presenza di ossigeno e con mitocondri pienamente funzionanti. Questo fenomeno, ampiamente studiato, è noto come Effetto Warburg. Questo effetto consente loro di metabolizzare rapidamente il glucosio in energia e utilizzarlo per alimentare la loro crescita incontrollata. In ambienti poveri di ossigeno, i tumori riprogrammano ulteriormente il loro metabolismo per dipendere dagli acidi grassi, i quali forniscono più energia per molecola rispetto al glucosio.
Mirare al metabolismo del cancro è da tempo un obiettivo degli oncologi, con diversi farmaci che tentano di bloccare l’assorbimento di glucosio e acidi grassi nelle cellule tumorali. Tuttavia, sopprimere direttamente questi percorsi nei pazienti oncologici può influenzare anche le cellule sane, portando a gravi effetti collaterali. Per questo motivo, i ricercatori di questo nuovo studio hanno proposto una strategia diversa: ingegnerizzare cellule adipose che competano naturalmente con i tumori per le risorse, affamando così il cancro.
Adipociti Ingegnerizzati con Elevato Consumo Energetico
Il team di ricerca ha utilizzato la tecnologia di attivazione di CRISPR (CRISPRa) per modificare il tessuto adiposo bianco (white adipose tissue, WAT), comunemente presente nel corpo umano, trasformandolo in cellule simili al tessuto adiposo bruno (brown adipose tissue, BAT). Il grasso bruno, a differenza di quello bianco, è altamente attivo dal punto di vista metabolico e brucia grandi quantità di glucosio e acidi grassi per generare calore. Attivando geni come UCP1, PRDM16 e PPARGC1A, gli scienziati hanno indotto questa trasformazione negli adipociti umani e hanno osservato un notevole aumento del loro consumo energetico.
Negli esperimenti di laboratorio, questi adipociti ingegnerizzati sono stati posizionati in prossimità di diversi tipi di cellule tumorali, tra cui quelle del cancro al seno, al pancreas e alla prostata. I risultati sono stati straordinari: la proliferazione delle cellule tumorali è diminuita drasticamente, mentre i tumori lottavano per accedere ai nutrienti necessari per la loro sopravvivenza. Gli adipociti modificati sono stati inoltre in grado di ridurre l’assorbimento di glucosio e l’ossidazione degli acidi grassi nelle cellule tumorali, tagliando così la loro principale fonte di energia.
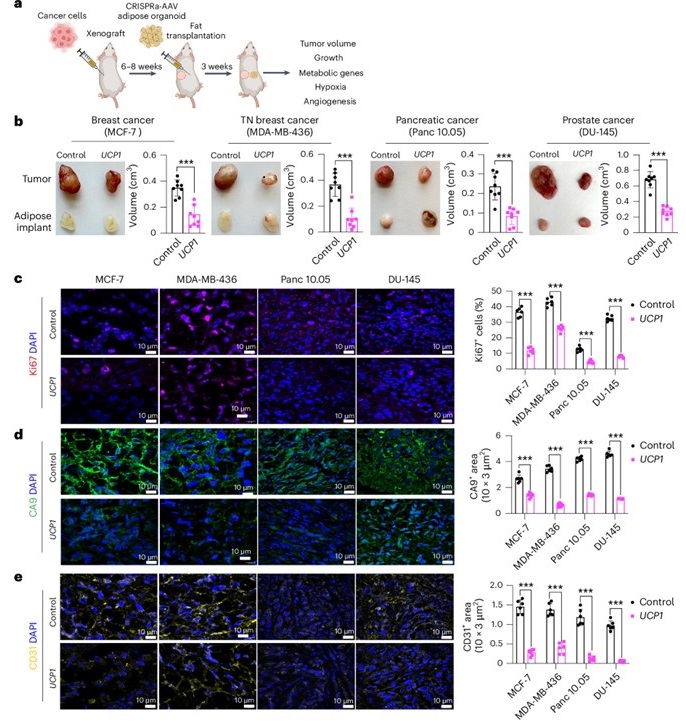
Successo nei Modelli Animali
Per testare l’efficacia di questo approccio negli organismi viventi, i ricercatori hanno impiantato questi organoidi adiposi modificati in modelli murini geneticamente ingegnerizzati per sviluppare il cancro al pancreas e al seno. In entrambi i casi, la crescita tumorale è stata sopressa in modo significativo. Le cellule adipose impiantate non solo hanno sottratto ai tumori glucosio e acidi grassi, ma hanno anche ridotto l’angiogenesi—la formazione di nuovi vasi sanguigni che riforniscono i tumori di nutrienti. Inoltre, i tumori hanno mostrato meno ipossia, una condizione di privazione di ossigeno che normalmente alimenta la progressione aggressiva del cancro.
Ulteriori studi su organoidi tumorali derivati da pazienti hanno rivelato risultati simili. Quando gli adipociti mammari umani sono stati ingegnerizzati con la tecnologia CRISPRa e co-coltivati con organoidi tumorali del seno, la proliferazione tumorale è diminuita significativamente. Questo suggerisce che l’AMT potrebbe rappresentare un’opzione terapeutica promettente anche per i pazienti oncologici umani.
Terapia Personalizzabile e Adattabile
Uno degli aspetti più interessanti di questo approccio è la sua potenziale personalizzazione. Oltre a prendere di mira il metabolismo di glucosio e acidi grassi, i ricercatori hanno esplorato la capacità dell’AMT di competere con i tumori per altri metaboliti essenziali. Ad esempio, i ricercatori hanno attivato il gene UPP1 negli organoidi adiposi, consentendo loro di competere con l’adenocarcinoma duttale pancreatico (pancreatic ductal adenocarcinoma, PDA) per l’uridina, un’altra molecola metabolica chiave utilizzata da alcuni tumori. Ciò ha ulteriormente inibito la crescita tumorale, dimostrando che l’AMT potrebbe essere adattato a diversi tipi di cancro in base alle loro specifiche dipendenze metaboliche.
Inoltre, il team di ricerca ha sviluppato un sistema di somministrazione controllata utilizzando scaffold biodegradabili per impiantare gli organoidi adiposi ingegnerizzati vicino ai tumori. Questo permette una facile rimozione o sostituzione della terapia, se necessario. I ricercatori hanno anche creato una versione inducibile della terapia utilizzando un sistema controllato dalla tetraciclina, il quale consente di attivare o disattivare i geni su richiesta, offrendo un livello di controllo e sicurezza non presente in molti trattamenti oncologici esistenti.
Una Nuova Frontiera nella Terapia del Cancro
Questo lavoro pionieristico introduce una potenziale strategia innovativa nella cura del cancro—un approccio che non si basa su farmaci tossici o radiazioni, ma che sfrutta invece le cellule adipose del corpo per combattere i tumori. A differenza della chemioterapia, che spesso comporta gravi effetti collaterali, l’AMT rappresenta un’opzione potenzialmente più sicura e mirata. Dato che la liposuzione e il trapianto di grasso sono già procedure mediche comuni, adattare questa terapia all’uso clinico potrebbe essere un processo relativamente semplice.
Sebbene siano necessarie ulteriori ricerche prima che l’AMT possa essere ampiamente applicato agli esseri umani, i risultati dello studio offrono delle prospettive promettenti sul futuro della terapia oncologica. Riprogrammando le cellule adipose in macchine “bruciagrassi”, gli scienziati potrebbero aver identificato un metodo nuovo ed efficace per combattere il cancro senza danneggiare i tessuti sani. Se i trial clinici avranno successo, l’AMT potrebbe rivoluzionare il trattamento del cancro, fornendo ai pazienti un nuovo potente strumento nella loro lotta contro questa malattia.