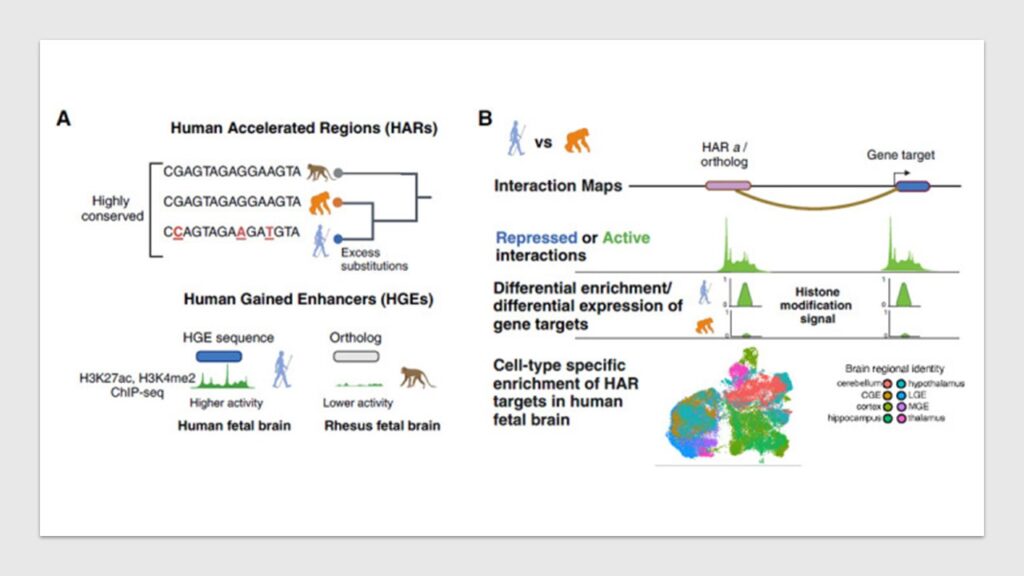
Il cervello umano è una meraviglia dell’evoluzione, caratterizzato da tratti unici come un’aumentata superficie corticale, una neurogenesi prolungata e un’elevata plasticità sinaptica. Gli scienziati hanno a lungo cercato di svelare i fattori genetici dietro questi sviluppi. Una scoperta cruciale in questo ambito è la presenza delle Human Accelerated Regions (HAR)—tratti di DNA che sono rimasti altamente conservati tra le specie ma che mostrano un’evoluzione rapida negli esseri umani. Si ritiene che le HAR funzionino come enhancer trascrizionali, regolando geni coinvolti nello sviluppo neurologico. Tuttavia, i geni e le vie precise che influenzano questo processo sono rimasti in gran parte sconosciuti.
Una recente ricerca della Yale University pubblicata su Cell ha gettato nuova luce su questo mistero, mappando le interazioni della cromatina delle HAR e dei loro ortologhi nelle cellule staminali neurali (Neural Stem Cells, NSC) nell’uomo e nello scimpanzé. Lo studio ha cercato di capire se le HAR agiscano alterando l’espressione dei geni bersaglio esistenti o acquisendone di nuovi, in un meccanismo noto come enhancer hijacking. I risultati indicano che le HAR regolano prevalentemente un insieme conservato di geni, molti dei quali sono implicati nello sviluppo neurologico, piuttosto che acquisire nuovi bersagli.
Mappare le interazioni delle HAR
Per svelare il ruolo delle HAR, i ricercatori hanno utilizzato la Capture Hi-C (CHi-C), una tecnica che permette la mappatura ad alta risoluzione delle interazioni della cromatina. Questo metodo è stato applicato a 1.590 HAR e 466 Human Gained Enhancers (HGE), un’altra classe di elementi regolatori che mostrano attività specifica nell’uomo. Lo studio ha confrontato i geni bersaglio tra le NSC umane e quelle dello scimpanzé per determinare se le HAR influenzino geni specifici della specie o geni conservati.
I risultati hanno rivelato che l’88,9% delle HAR e il 75,8% degli HGE nelle NSC umane hanno geni bersaglio identificabili. In particolare, 2.963 geni sono conservati tra entrambe le specie, con un potenziamento significativo nelle funzioni neuro-evolutive come la guida degli assoni, la trasmissione sinaptica e la migrazione neuronale. Al contrario, i geni bersaglio specifici della specie non mostrava nessun potenziamento significativo per le funzioni biologiche o l’espressione genica differenziale, suggerendo che le HAR operano prevalentemente all’interno di vie conservate piuttosto che attraverso l’enhancer hijacking.
Collegare le HAR ai geni neuro-evolutivi
Una domanda chiave è se le HAR regolano direttamente i geni con cui interagiscono. Per rispondere a questa domanda, i ricercatori hanno utilizzato la CRISPR activation (CRISPRa) e la CRISPR interference (CRISPRi) per potenziare o reprimere rispettivamente l’attività delle HAR e dei loro ortologhi nello scimpanzé. Un esempio è dato da HACNS52, il quale regola i geni ANXA2 e ICE2, entrambi con un’espressione potenziata nelle aree progenitrici del cervello fetale umano. I risultati sperimentali hanno confermato che la repressione di HACNS52 porta a una diminuzione dell’espressione di questi geni, mentre l’attivazione ne comporta un aumento.
Un’analisi più approfondita ha rivelato che i geni bersaglio delle HAR sono significativamente sovrarappresentati tra i geni che mostrano variazioni di espressione specifiche dell’uomo durante lo sviluppo e nell’età adulta del cervello. Ciò suggerisce che le HAR contribuiscano alle caratteristiche uniche del cervello umano, modulando finemente l’espressione di geni già presenti nelle vie di sviluppo neurologico dei primati.
Le HAR e il loro ruolo nell’attivazione degli enhancer
Un risultato inaspettato è stato che alcune HAR e HGE stabiliscono interazioni regolatorie in uno stato represso nelle NSC, ma queste poi si attivano durante la differenziazione neuronale. Ad esempio, HAR116, che interagisce con il gene TCF20, passa da uno stato represso nelle NSC a uno stato attivo nei neuroni, corrispondente a un aumento dell’espressione di TCF20. Questo indica che le HAR potrebbero agire come interruttori di sviluppo, influenzando l’espressione genica in fasi critiche dello sviluppo cerebrale.
Il contesto cellulare: HAR nei sottotipi neurali
Per comprendere gli ambienti cellulari in cui operano le HAR, i ricercatori hanno integrato i loro dati con gli atlanti di espressione a singola cellula del cervello umano durante lo sviluppo. Gli scienziati hanno scoperto che molti geni regolati dalle HAR sono preferenzialmente espressi nella glia radiale esterna (oRG), una popolazione di progenitori neurali considerata come chiave per l’espansione corticale. Inoltre, geni come ANXA2, ROBO1 e PLAGL1 hanno mostrato una forte espressione preferenziale nelle oRG, rafforzando ulteriormente l’idea che le HAR contribuiscano all’architettura unica del cervello umano.
Affrontare l’ipotesi del enhancer hijacking
Un grande dibattito nella genetica evolutiva è se le HAR contribuiscano ai tratti specifici dell’uomo attraverso l’enhancer hijacking, acquisendo nuovi bersagli genici non presenti nelle specie ancestrali. Questo studio ha trovato poche prove a supporto di questa teoria. Invece, le HAR regolano prevalentemente geni che sono già bersaglio dei loro ortologhi dello scimpanzé. Ciò suggerisce un modello conservativo di evoluzione cerebrale, in cui i tratti unici umani emergono attraverso modifiche delle reti regolatorie geniche esistenti, piuttosto che attraverso una loro completa ristrutturazione.
Implicazioni per la comprensione dei disturbi neuro-evolutivi
Curiosamente, lo studio ha anche rilevato che i geni bersaglio potenziati delle HAR includono quelli associati ai disturbi dello spettro autistico e alla schizofrenia. Questo solleva la possibilità che le variazioni genetiche nelle HAR possano contribuire al rischio di queste condizioni, alterando i normali meccanismi di regolazione genica. Studi futuri potrebbero cercare di capire se le mutazioni nelle HAR siano correlate ai disturbi neuro-evolutivi, fornendo nuove prospettive sulle loro basi genetiche.
Conclusione: Una roadmap per la ricerca futura
Questa ricerca rappresenta un passo significativo nella comprensione di come questi elementi genetici specifici dell’uomo modellino l’evoluzione cerebrale. Creando una mappa ad alta risoluzione delle interazioni delle HAR, lo studio fornisce una solida base per ulteriori indagini mirate sui ruoli funzionali delle HAR.
Le future direzioni di ricerca includono lo studio delle HAR in modelli più complessi come gli organoidi cerebrali o i modelli murini umanizzati, l’analisi degli effetti combinatori di più HAR, poiché singole HAR possono avere effetti sottili che diventano significativi in combinazione, e l’esplorazione di altri contesti di sviluppo oltre quello del cervello, come lo sviluppo degli arti, dove le HAR potrebbero aver un ruolo centrale.




