Di Paolo Rega
In un importante passo avanti per l’ingegneria genetica e l’immunoterapia, un gruppo di ricercatori del Karolinska Institutet ha sviluppato un innovativo sistema CRISPR optogenetico che consente di modificare i geni nei linfociti T in modo preciso e controllato tramite la luce — persino all’interno di organismi viventi. Il sistema, chiamato BLU-VIPR (Blue Light-inducible Universal VPR-Improved Production of RGRs), permette di attivare o disattivare l’editing genetico utilizzando la luce blu, offrendo di fatto un controllo remoto per la manipolazione genetica altamente specifica.
Lo studio, pubblicato recentemente sulla rivista Nucleic Acids Research, non solo presenta uno strumento potente per la ricerca di base, ma apre anche nuove prospettive terapeutiche per il trattamento di malattie come il cancro attraverso terapie geniche più mirate e meno invasive.
CRISPR Incontra la Luce
La tecnologia CRISPR ha rivoluzionato l’editing genetico, permettendo di tagliare e modificare il DNA con una precisione sorprendente. Tuttavia, controllare quando e dove avviene l’editing rimane una sfida cruciale — in particolare negli animali viventi. I sistemi CRISPR tradizionali, una volta introdotti nelle cellule, rimangono sempre “attivi”, il che può portare a effetti indesiderati e rendere complicato lo studio di processi biologici dinamici.
Ed è qui che entra in gioco l’optogenetica, una tecnica che utilizza la luce per controllare l’attività cellulare. Già ampiamente utilizzata nelle neuroscienze per attivare neuroni con il laser, l’optogenetica è stata combinata dal team del Karolinska con l’editing genetico, creando un sistema totalmente nuovo.
Dal Focus sulle Proteine al Controllo dell’RNA Guida
La particolarità di BLU-VIPR risiede nel suo approccio unico: anziché agire sulla proteina Cas9 (l’enzima che taglia il DNA), il sistema controlla la produzione dell’RNA guida (gRNA), che dirige Cas9 verso il punto esatto da modificare.
I precedenti sistemi CRISPR optogenetici si basavano spesso sulla scissione dell’enzima Cas9 in due parti, da riunire successivamente tramite luce. Tuttavia, queste versioni risultavano ingombranti e difficili da veicolare nelle cellule, soprattutto nei linfociti T, che sono notoriamente complessi da manipolare ma fondamentali per le risposte immunitarie e le terapie cellulari.
Per superare queste limitazioni, i ricercatori hanno ingegnerizzato un fattore di trascrizione sensibile alla luce chiamato VPR-EL222. Una volta esposto alla luce blu (470 nm), questo attiva la trascrizione di un RNA che contiene sia una proteina reporter (come mCherry) che il gRNA. Il gRNA è inserito in una struttura chiamata RGR (ribozyme-gRNA-ribozyme), che include ribozimi auto-taglianti: una volta prodotto l’RNA, questi enzimi liberano il gRNA funzionale pronto per guidare Cas9.
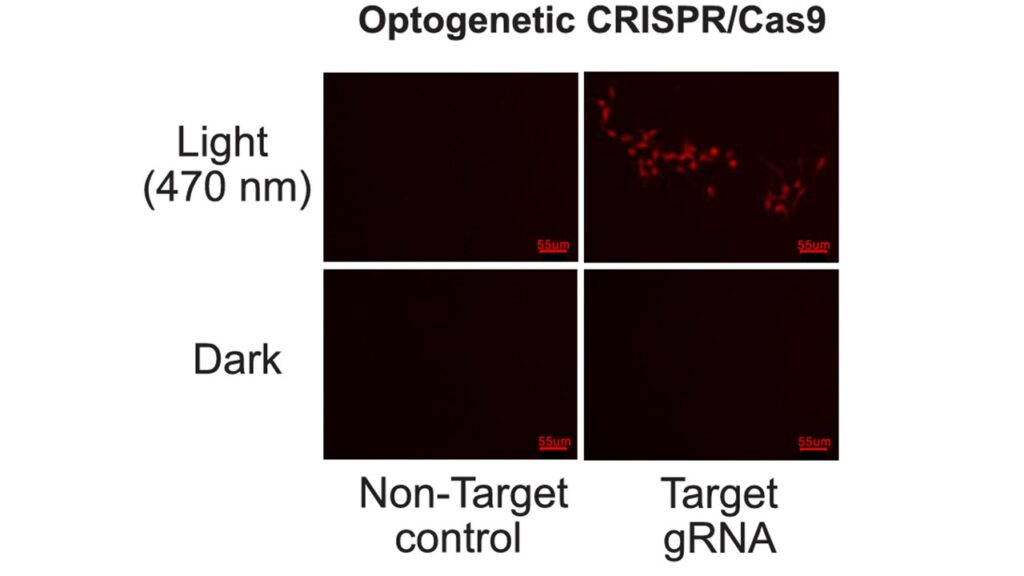
Trasformare la Luce in Modifiche Genetiche: Validazione Finale
Per verificare il funzionamento del sistema, il team ha utilizzato cellule HEK293T esponendole alla luce blu. È stato progettato un sistema reporter in cui un gene chiamato tdTomato si illumina solo se il DNA viene corretto da Cas9. I risultati sono stati eloquenti: dopo l’illuminazione, le cellule hanno iniziato a emettere fluorescenza rossa, segno evidente di editing genetico attivato dalla luce.
Ma i ricercatori non si sono fermati qui. Hanno anche dimostrato che BLU-VIPR è in grado di eseguire non solo modifiche classiche (indels), ma anche attivazione genica (CRISPRa) e base editing, cioè la sostituzione di una singola lettera del DNA (A, C, T, G) con un’altra in modo chimicamente controllato.
Modularità e Attivazione Multipla
Un ulteriore punto di forza del sistema BLU-VIPR è la sua modularità. Inserendo più unità RGR nello stesso trascritto, il sistema può produrre contemporaneamente diversi gRNA che prendono di mira geni differenti. Ancora più sorprendente è stata la dimostrazione della attivazione ortogonale, ottenuta usando due diversi effettori Cas — dCas9-VPR e dCas12a-VPR — controllati da gRNA distinti all’interno dello stesso messaggio attivato dalla luce.
La Prova Reale: I Linfociti T nei Topi Vivi
La parte più ambiziosa dello studio ha coinvolto i linfociti T, le cellule dell’immunità adattativa. Come osservato, queste cellule sono notoriamente difficili da modificare geneticamente, soprattutto con strumenti optogenetici che richiedono vettori di grandi dimensioni.
Utilizzando retrovirus, i ricercatori hanno trasferito le sequenze di BLU-VIPR in linfociti T primari isolati da topi transgenici esprimenti Cas9. Dopo l’esposizione alla luce blu, è stato osservato il knockout efficace del gene Thy1.2, un marcatore di superficie. Da notare che, senza luce, non si verificava alcun editing, e questo dimostra un controllo estremamente preciso.
Il test definitivo è arrivato con l’editing optogenetico in vivo. Con una procedura chirurgica derivata dalla microscopia intravitale, è stato esposto alla luce blu un singolo linfonodo in topi vivi per un’ora. Entro 48 ore, il team ha rilevato modifiche genetiche nei linfociti T proprio in quel punto — e solo in quel punto.
Implicazioni per l’Immunoterapia di Precisione
Pur trattandosi di una tecnologia ancora in fase iniziale, le potenzialità sono immense.
In futuro, terapie immunitarie come le CAR-T potrebbero essere progettate con BLU-VIPR per attivare o silenziare geni solo quando necessario — ad esempio, all’interno di un tumore o in risposta a segnali specifici. Questo ridurrebbe gli effetti collaterali e migliorerebbe la sicurezza dei trattamenti. La piattaforma potrebbe trovare impiego anche nelle neuroscienze, nella biologia dello sviluppo e in tutti quei campi dove il controllo spazio-temporale dei geni è cruciale.
Naturalmente, restano delle sfide. BLU-VIPR richiede la penetrazione della luce blu, che è limitata nei tessuti profondi. Tuttavia, sono già in fase di sviluppo sistemi optogenetici a lunghezza d’onda più lunga (luce rossa), combinati con vettori virali avanzati (come gli AAV) per una consegna più efficace. Inoltre, la necessità della presenza della proteina Cas nelle cellule può essere superata grazie a modelli transgenici o strategie di co-delivery.


Leave a Reply